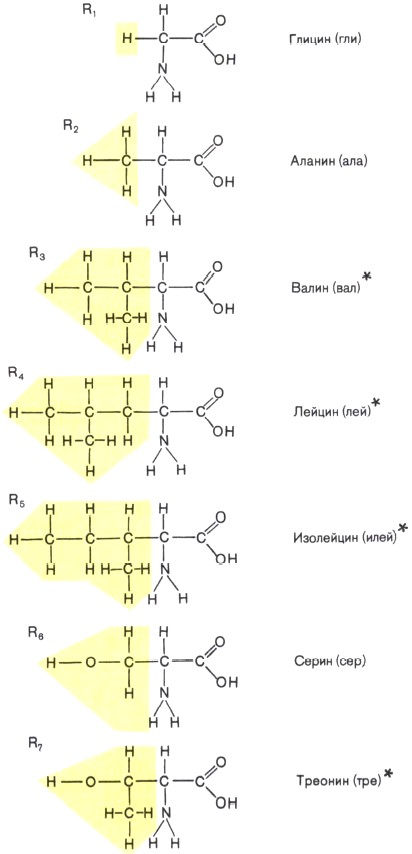
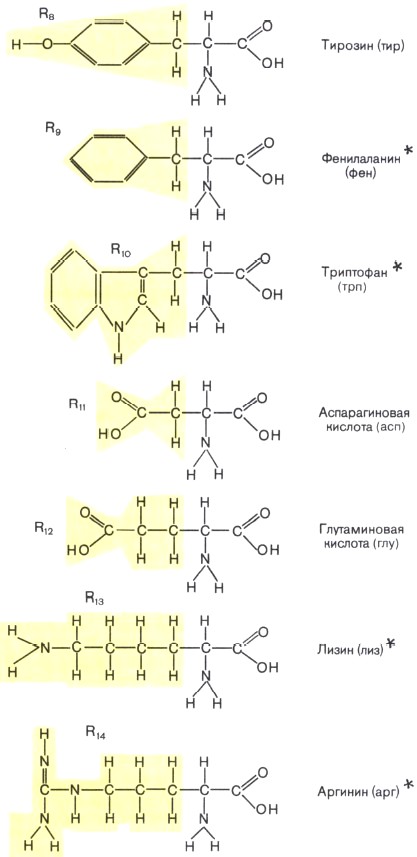
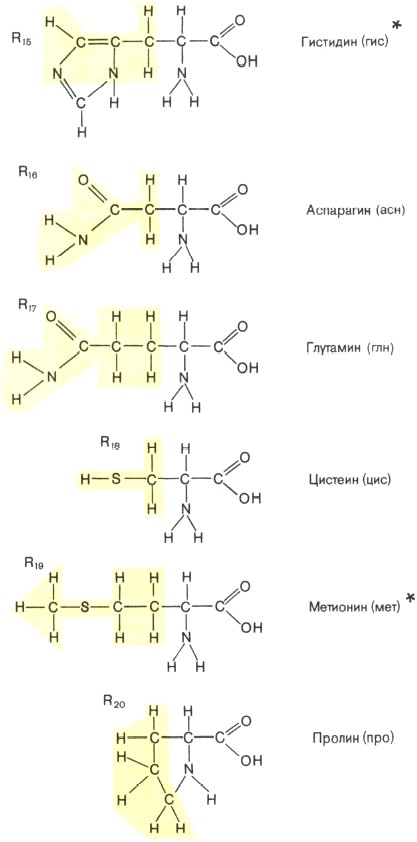
Состав белков. Белки — обязательная составная часть всех клеток. В состав этих биополимеров входят мономеры 20 типов. Такими мономерами являются аминокислоты, которые получили свое название потому, что содержат и аминогруппу (—NH2), и кислотную карбоксильную группу (—СООН). Каждая из 20 аминокислот имеет одинаковую часть, включающую обе эти группы и отличается от любой другой особой химической группировкой, так называемой R-группой, или радикалом
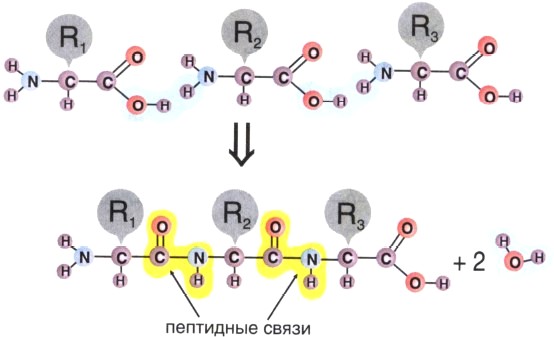
Образование линейных молекул белков происходит в результате соединения аминокислот друг с другом. Карбоксильная группа одной аминокислоты сближается с аминогруппой другой, и при отщеплении молекулы воды между аминокислотными остатками возникает прочная ковалентная связь, называемая пептидной. Соединение, состоящее из большого числа аминокислот, называется полипептидом. Каждый белок по своему химическому строению является полипептидом. Некоторые белки состоят из нескольких полипептидных цепей. В составе большинства белков находится в среднем 300—500 остатков аминокислот. Известно несколько очень коротких природных белков, длиной в 3—8 аминокислот, и очень длинных биополимеров, длиной более чем в 1500 аминокислот.
Строение белков. Выделяют первичную, вторичную, третичную и четвертичную структуры белков.
Первичная структура I определяется порядком чередования аминокислот в полипептидной цепи. Двадцать разных аминокислот можно уподобить 20 буквам химического алфавита, из которых составлены «слова» длиной в 300—500 букв. С помощью 20 букв можно написать безграничное множество таких длинных слов. Если считать, что замена или перестановка хотя бы одной буквы в слове придает ему новый смысл, то число комбинаций в слове длиной в 500 букв составит 20500.
Известно, что замена даже одного аминокислотного звена другим в белковой молекуле изменяет ее свойства. В каждой клетке содержится несколько тысяч разных видов белковых молекул, и для каждого из них характерна строго определенная последовательность аминокислот. Именно порядок чередования аминокислот в данной белковой молекуле определяет ее особые физико-химические и биологические свойства. Исследователи умеют расшифровывать последовательность аминокислот в длинных белковых молекулах и синтезировать такие молекулы.
В живой клетке многие молекулы белков или их отдельные участки представляют собой не вытянутую нить, а спираль с одинаковыми расстояниями между витками. Такая спираль представляет собой вторичную структуру белковой молекулы II.
Между группами N—Н и С=0, расположенными на соседних витках, возникают водородные связи. Они намного слабее ковалентных, но, повторенные многократно, скрепляют регулярные витки спирали.
Спираль обычно свернута в клубок. Этот клубок образован закономерным переплетением участков белковой цепи. Положительно и отрицательно заряженные R-группы аминокислот притягиваются и сближают даже далеко отстоящие друг от друга участки белковой цепи. Сближаются и иные участки белковой молекулы, несущие, например, «водоотталкивающие» (гидрофобные) радикалы. В результате взаимодействия различных остатков аминокислот спирализованная молекула белка образует клубок — третичную структуру (рис. 6, III). Для каждого вида белка характерна своя форма клубка с изгибами и петлями. Третичная структура зависит от первичной структуры, т. е. от порядка расположения аминокислот в цепи.
Наконец, некоторые белки, например гемоглобин, состоят из нескольких цепей, различающихся по первичной структуре. Объединяясь вместе, они создают сложный белок, обладающий не только третичной, но и четвертичной структурой IV.
Схема строения белковой молекулы
I - первичная структура; II - вторичная структура; III - третичная структура; IV - четвертичная структура
Под действием ионизирующей радиации, высокой температуры, сильного взбалтывания, экстремальных значений pH, а также ряда органических растворителей, таких, как спирт или ацетон, белки изменяют свое естественное состояние. Нарушение природной (нативной) структуры белка называют денатурацией. Подавляющее большинство белков утрачивает при этом биологическую активность, хотя первичная структура их после денатурации не меняется. Дело в том, что в процессе денатурации нарушаются вторичная, третичная и четвертичная структуры, обусловленные слабыми взаимодействиями между аминокислотными остатками, а ковалентные пептидные связи не разрываются. Необратимую денатурацию можно наблюдать при нагревании жидкого и прозрачного белка куриного яйца: он становится плотным и непрозрачным. Денатурация может быть и обратимой. После устранения денатурирующего фактора многие белки способны вернуть естественную форму, т. е. ренатурироватъ.
Способность белков к обратимому изменению пространственной структуры в ответ на действие физических или химических факторов лежит в основе раздражимости — важнейшего свойства всех живых существ.